k8凯发(中国)天生赢家·一触即发
 k8凯发介绍
企业简介
企业文化
联系我们
新闻资讯
公司新闻
媒体报导
凯发k8天生赢家一触即发登录入口
产品服务
营销事业部
产品展示
儿童用药产品系列
妇科用药产品系列
抗生素类产品系列
呼吸系统用药产品系列
消化系统用药产品系列
学术推广
k8凯发(中国)天生赢家·一触即发
社会责任
人力资源
k8凯发介绍
企业简介
企业文化
联系我们
新闻资讯
公司新闻
媒体报导
凯发k8天生赢家一触即发登录入口
产品服务
营销事业部
产品展示
儿童用药产品系列
妇科用药产品系列
抗生素类产品系列
呼吸系统用药产品系列
消化系统用药产品系列
学术推广
k8凯发(中国)天生赢家·一触即发
社会责任
人力资源
近日★◈◈★,我国首个新冠疫苗获批附条件上市★◈◈★。据国务院联防联控机制新闻发布会介绍★◈◈★,从全球第一个新冠疫苗获批开展一★◈◈★、二期临床试验★◈◈★,到全球第一个启动三期临床试验★◈◈★,再到第一个疫苗附条件上市★◈◈★,我国新冠疫苗研发工作始终处于全球第一方阵★◈◈★。
中国新冠疫苗研发为何能处于全球领先位置?这背后既有科研工作者的努力★◈◈★,也有体制机制的保障★◈◈★。新冠疫苗的研发经历★◈◈★,给我国健康事业发展和科技创新能带来什么启示?值得思考★◈◈★。
作为一名药品政策研究者★◈◈★,笔者近来与国外学者交流时★◈◈★,被问到这样一个问题★◈◈★:中国的疫苗创新能力和监管能力并不强于一些发达国家凯发k8★◈◈★,为什么在新冠疫苗研发中却稳稳位列全球第一梯队?听得出来★◈◈★,国外学者对中国新冠疫苗抱有善意★◈◈★,但也存在疑虑★◈◈★。笔者当时笑着回答★◈◈★,这是一个好问题★◈◈★,值得我们思考★◈◈★。这个问题的答案dnf武者★◈◈★,或许也能为我国其他科技攻关问题提供启示★◈◈★。

疫苗是传染病大流行的“终止键”★◈◈★。我国抗击新冠肺炎疫情的战略目标★◈◈★,是保持不发生本地传播或者使传播维持在较低水平★◈◈★,直至研发出安全有效的疫苗★◈◈★,并广泛接种以形成人群免疫屏障★◈◈★。
据世界卫生组织网站发布的数据显示★◈◈★,截至2020年12月29日★◈◈★,全世界共有232种新冠疫苗处于活跃研发状态★◈◈★,其中60种进入临床试验阶段★◈◈★。在处于三期临床试验的15种疫苗中★◈◈★,中国占据了5种★◈◈★。不论是在国际上率先公布非人灵长类动物模型中灭活疫苗有效的评价结果★◈◈★,还是正式发表全球首个新冠疫苗人体临床试验数据★◈◈★,或是已进入三期临床试验的候选疫苗数量★◈◈★,中国始终处于全球前列★◈◈★,进展令人鼓舞★◈◈★。
我国还是世界上为数不多的能够依靠自身力量解决全部免疫规划疫苗的国家之一★◈◈★,疫苗年产能超过10亿剂次★◈◈★,2011年和2014年两次通过世界卫生组织疫苗国家监管体系(NRA)评估★◈◈★。可以说★◈◈★,中国人的针筒里装着自己的疫苗★◈◈★。
当然★◈◈★,在看到成绩的同时★◈◈★,我们必须承认疫苗产业创新和监管效能还有较大提升空间★◈◈★。据了解★◈◈★,目前全国仅有4个疫苗产品获得世界卫生组织预认证(PQ)★◈◈★,相比而言韩国有10个★◈◈★,印度更高达51个★◈◈★。近年来发生的多起疫苗事件★◈◈★,带来公共卫生安全风险★◈◈★,成就和挑战并存★◈◈★。
围绕疫苗体系现状★◈◈★,我们需要思考新冠疫苗研发能力的形成路径★◈◈★,讲好新冠疫苗研发的“中国故事”★◈◈★:市场经济★◈◈★、突发事件★◈◈★、全球化等多重条件约束下的新型举国体制凯发k8★◈◈★,在新冠疫苗研发中究竟是如何彰显制度优势的?
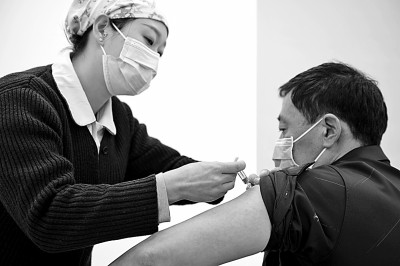
2021年1月2日★◈◈★,在北京市朝阳区太阳宫社区卫生服务中心★◈◈★,医护人员为接种人员注射疫苗★◈◈★。新华社发
传染病大流行是风险社会的典型现象★◈◈★。应对传染病涉及多元主体★◈◈★,且知识★◈◈★、资源★◈◈★、信息高度分散★◈◈★。由于政府单边行政难以解决所有现实问题★◈◈★,需要通过协同治理激发市场★◈◈★、社会的内生动力★◈◈★。依据这一理论框架dnf武者★◈◈★,我们从动力和行动两个方面★◈◈★,分析新冠疫苗研发过程★◈◈★。
一方面是动力★◈◈★,也就是坚持以人民健康为中心的战略目标★◈◈★。突发公共卫生事件放大了疫苗研发不确定性★◈◈★,市场机制容易失灵★◈◈★。因此在疫情初期★◈◈★,众多跨国制药公司主要出于商业考量★◈◈★,并未大规模投入疫苗研发★◈◈★。他们或是担心研发失败★◈◈★,或是对疫情存续抱有侥幸心理★◈◈★。
我国情况则不同凯发k8★◈◈★。基于对新冠疫苗战略价值的深刻认识★◈◈★,国家要求科研攻关单位“不算经济收益账★◈◈★,只算人民健康账”★◈◈★,并给予专项资金保障★◈◈★。我国关于建立国家疫苗储备制度的要求★◈◈★,以及中国新冠疫苗将作为全球公共产品的承诺★◈◈★,更是为企业提供了广阔市场空间★◈◈★。这种可信承诺强化了正向激励和预期★◈◈★,从而有效纠正市场失灵★◈◈★,加速疫苗研发进程★◈◈★。国家的底线思维和战略定力在于★◈◈★,哪怕备而不用★◈◈★,哪怕病毒消失了★◈◈★,哪怕投入打水漂凯发k8★◈◈★,也要坚持疫苗研发★◈◈★。事实证明★◈◈★,从2020年1月科技部启动第一批应急攻关项目★◈◈★,到7月多家中资企业在海外开展三期临床试验★◈◈★,以及12月相关数据陆续公布★◈◈★,新冠疫苗研发的“中国速度”不仅远快于通常所需的5-18年★◈◈★,还超越了大流行情境中12-18个月的疫苗研发周期★◈◈★。
另一方面是在这种共识下的行动★◈◈★,也就是疫苗研发各方彼此帮衬★◈◈★、相互依存★◈◈★。疫苗研发涉及多个部门★◈◈★,“碎片化”格局主要表现在政策协调和资源共享两方面★◈◈★,不易构建起激励研发的制度体系★◈◈★。比如科学家希望创新出具有广谱免疫应答的疫苗★◈◈★,但这同时意味着更多异常反应★◈◈★,因此监管部门认为其安全性是难以接受的★◈◈★。又比如疫苗研发资源散布在科学院★◈◈★、科技部★◈◈★、高等院校★◈◈★、部队★◈◈★、央企★◈◈★、医疗机构等系统★◈◈★,过去他们之间缺乏有效合作★◈◈★。为了在紧急状态下组织动员全国优势力量实现特定科技创新目标★◈◈★,国务院联防联控机制科研攻关组于2020年2月成立疫苗专班★◈◈★。该专班由科技部★◈◈★、卫生健康委★◈◈★、药品监督管理局等部门组成★◈◈★,其担负起协调部门间目标★◈◈★、同向发力的重任★◈◈★。其有力凝聚起医疗机构★◈◈★、科研机构★◈◈★、企业和监管部门的全部优势力量和要素★◈◈★,实现毒株分离★◈◈★、动物试验★◈◈★、产品制备★◈◈★、临床研究等工作“医研审产”联动★◈◈★,从而在尊重科学规律的前提下推动疫苗研发★◈◈★。

2020年12月25日dnf武者★◈◈★,工作人员在国药集团中国生物北京生物制品研究所的新冠病毒灭活疫苗分包装车间内工作★◈◈★。新华社发
协同行动同样表现在政府和市场关系上★◈◈★。新冠疫苗是全新事物★◈◈★,需要调动科研单位的自主性和内生动力★◈◈★,长期投入研发和积累知识★◈◈★。应对重大危机的能力★◈◈★,是一次次危机倒逼出来的★◈◈★。从2003年非典事件以来★◈◈★,科研单位借助禽流感★◈◈★、甲流★◈◈★、埃博拉等多次新发突发传染病的政策窗口★◈◈★,充分利用国家的支持性体制机制★◈◈★,持续放大有用知识的积累★◈◈★,在技术平台等方面取得重大突破★◈◈★。在新冠疫苗研发中★◈◈★,政府有效嵌入产学研网络★◈◈★,动态掌握前沿信息★◈◈★,疫情伊始就重点支持5条技术路线项疫苗研发任务同步推进★◈◈★。疫苗专班引入科研攻关“竞跑”机制★◈◈★,这种精准识别和支持“高手”和尊重研发主体经济利益的方式★◈◈★,引导疫苗研发产业链上下游紧密联动★◈◈★,共同与病毒赛跑★◈◈★。于是★◈◈★,在习惯集中力量办大事的大国凯发k8★◈◈★,企业成为新冠疫苗研发的线.并非传统意义上的集中力量办大事★◈◈★,尊重市场的新型举国体制提高研发效率
归纳而言★◈◈★,新型举国体制体现在新冠疫苗研发中dnf武者★◈◈★,是以国家公共卫生安全和人民健康为政策目标dnf武者★◈◈★,科学统筹★◈◈★、集中力量★◈◈★、优化制度凯发k8★◈◈★、协同攻关★◈◈★,聚焦疫情防控的战略制高点★◈◈★,实现高质量发展和高效能治理的制度安排★◈◈★。其中★◈◈★,党的集中统一领导破解了市场失灵和“碎片化”政策体系★◈◈★。“只算人民健康账dnf武者★◈◈★、不算经济账”的战略决策★◈◈★,为科研攻关单位大规模投入研发提供了可信承诺和一致目标★◈◈★。以疫苗研发工作专班为代表的制度化保障★◈◈★,不仅实现了药监部门与科技部门的高度协同★◈◈★,还改变了各主体成本收益权衡★◈◈★,塑造医疗机构★◈◈★、科研单位★◈◈★、监管部门★◈◈★、企业★◈◈★、部队等主体协同行动★◈◈★,最大限度提高研发效率★◈◈★。良好的协同结果正向反馈给上述目标和结构★◈◈★,进一步强化协同行动的实施★◈◈★,从而形成良性循环dnf武者★◈◈★。中国新冠疫苗研发成功不是偶然的★◈◈★,其源自研发能力的长期积累dnf武者★◈◈★,包括与之相关联的药品检验★◈◈★、审评等监管能力进步★◈◈★,以及政府嵌入产业识别“高手”的政策网络★◈◈★。这既不是单纯市场演化的结果★◈◈★,也不是传统意义上的集中力量办大事★◈◈★,而是取决于两个因素交互作用★◈◈★:一是市场机制和企业利益被承认★◈◈★,二是国家充分发挥制度优势开展政治动员★◈◈★,这是一种尊重市场基础上的新型举国体制★◈◈★。换言之★◈◈★,知识积累和政策支持仅仅是静态的结果★◈◈★,新冠疫苗研发得益于协同体系及其运行★◈◈★。上述内容阐述了中国新冠疫苗研发的学理逻辑★◈◈★,有力回应西方某些人士片面认识★◈◈★。
新冠疫苗研发彰显出中国特色社会主义制度优势★◈◈★,其不是被设计出来的★◈◈★,而是在党的集中统一领导下★◈◈★,政府和企业彼此尊重★◈◈★、上下同欲★◈◈★、反复互动的实践结果★◈◈★。这种政策目标一致★◈◈★、政治动员有力★◈◈★、主体边界清晰的制度★◈◈★,我们在理论上称之为“举国协同”★◈◈★。从这个意义上说★◈◈★,研发能力的积累和政策窗口仅仅是新冠疫苗高效能研发的过程性变量★◈◈★,具有韧性和灵活性的举国协同才是催生这一成功的深层次制度因素★◈◈★,这对于强化国家战略科技力量更具有普遍且深远的意义★◈◈★。

日前★◈◈★,国务院联防联控机制新闻发布会上宣布★◈◈★,国药集团中国生物新冠灭活疫苗已获得国家药监局批准附条件上市★◈◈★。已有数据显示★◈◈★,保护率为79.34%★◈◈★,实现安全性★◈◈★、有效性★◈◈★、可及性★◈◈★、可负担性的统一★◈◈★,达到世界卫生组织及国家药监局相关标准要求★◈◈★。后续★◈◈★,疫苗免疫的持久性和保护效果还需持续观察★◈◈★。科技部副部长徐南平说★◈◈★,到目前为止★◈◈★,我国5条技术路线个疫苗进入临床试验★◈◈★,其中3条技术路线个疫苗进入Ⅲ期临床试验★◈◈★。
国家卫健委副主任★◈◈★、国务院联防联控机制科研攻关组疫苗研发专班负责人曾益新表示★◈◈★,12月15日正式启动了我国重点人群的接种工作★◈◈★,半个月来★◈◈★,全国重点人群累计接种已经超过了300万剂次★◈◈★。在接种工作中★◈◈★,建立了完善的接种点设置规范★◈◈★、接种人员严格的培训★◈◈★、受种人员的筛查★◈◈★、不良反应的监测★◈◈★、应急救治以及严重不良反应的专家会诊等一系列制度★◈◈★,来确保接种工作安全顺利★◈◈★。曾益新说★◈◈★:“这次的300万★◈◈★,加上之前的150万★◈◈★,充分证明了疫苗安全性良好★◈◈★。”《光明日报》( 2021年01月07日 16版)凯发国际娱乐★◈◈★!凯发k8官方旗舰厅★◈◈★,凯发k8天生赢家一触即发★◈◈★!癌症治疗★◈◈★,凯发k8国际(中国)官方网站·一触即发凯发k8一触即发★◈◈★!









